近年来,分析肿瘤组织样本的分子特征开始日益成为治疗肿瘤的重要手段之一。为了弄清楚肿瘤组织中的DNA和组织样本中的基因、蛋白表达是否发生了变化,以及发生了怎样的变化,科研人员进行了大量相关研究。
与此同时,研究人员越来越意识到癌症的进展与细胞间的相互作用以及赘生性细胞与周围组织(包括免疫系统)的相互作用密切相关。
柏林医科大学、柏林大学及奥斯陆大学近日基于人工智能(AI)技术,共同开发了一种新的组织切片分析系统,用于乳腺癌的诊断。
相比此前的技术,该系统有两方面进展,首先,研究人员首次将形态学、分子和形体数据集成在单一的分析中;其次,该系统以热图形式明确了AI决策过程。
据悉,这些热图可以逐像素地显示出影响AI决策过程的视觉信息、以及可影响到的程度,从而帮助医生检测微观图像中的病理变化,进而帮助理解和评估AI分析结果的合理性,可以说这将为“AI+医疗”起到关键性作用。
该项研究成果于2021年3月8日发表在《自然-机器智能》(NatureMachineIntelligence)杂志上,论文标题为《基于可解释机器学习进行乳腺癌形态学和分子生物学研究》(Morphologicalandmolecularbreastcancerprofilingthroughexplainablemachinelearning)。

图|相关论文
虽然显微技术能让科学家在进行生物进程研究时,掌握高度的空间细节,但却只能对分子标记进行有限的测量。并且由于这些标记都是通过从组织中提取的蛋白质或DNA来确定的,因此,通常无法获得空间细节,也无法明确这些标记和微观结构之间的关系。
该团队此次研发的可解释的机器学习方法,能够综合分析乳腺癌组织学的形态学、分子和临床特征。具体而言,该方法能从组织学角度预测DNA甲基化、基因表达、体细胞突变和蛋白质等分子特征,分子预测的均衡准确率高达78%,分子预测的平衡准确性达到78%,而亚组患者的预测准确率超过95%。

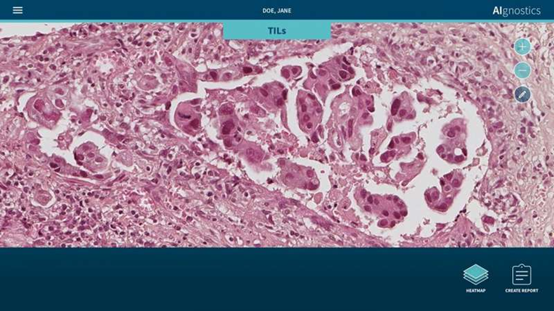
图|使用AI技术生成TILs(红色)及其他组织和细胞(蓝色和绿色)的热图
“我们知道在乳腺癌的情况下,肿瘤组织中迁移的免疫细胞(称为淋巴细胞)的数量对患者的预后具有影响,也有关于这个数字是否有预测价值的讨论,换句话说,它是否能让我们确定某种特定治疗方法的有效性。”查理特病理研究所的教授弗雷德里克・克劳申(FrederickKlauschen)博士表示。
“我们已经有了良好且可靠的分子数据,以及具有很高空间细节的组织学数据,目前我们缺乏的就是成像数据和高维分子数据之间的决定性联系,”柏林工业大学机器学习教授克劳斯-罗伯特・穆勒(Klaus-RobertMüller)博士补充道。上述两位研究人员已经在位于柏林工业大学的国家人工智能卓越中心——柏林国家学习和数据基础研究所(BIFOLD)合作多年。
图|乳腺癌组织样本
“我们的系统有助于显微镜图像中病理变化的检测。与此同时,我们提供的精确的可视化热图,还能显示出显微图像中的哪个像素对诊断算法有贡献,以及贡献的程度。”Müller教授解释道。
并且,该研究团队采用机器学习过程对其分析系统进行训练,因此该系统还可以根据组织学图像预测各种分子特征,包括DNA的状况、基因表达以及在特定的区域组织蛋白表达等。
接下来,他们将着手开展进一步的临床验证工作,包括肿瘤常规诊断的测试。
对于这项研究的价值,Klauschen坚信他们开发的方法会让未来更精确、更标准化的组织病理学肿瘤诊断成为可能。
2021年国际妇女节当天,世卫组织总干事谭德塞在发起全球应对乳腺癌倡议,据媒体报道:“预计到2040年,(如果)每年将乳腺癌死亡率降低2.5%,将挽救250万人的生命。此前世界卫生组织国际癌症研究机构(IARC)发布的2020全球癌症数据显示,乳腺癌新增人数达226万,肺癌为220万,乳腺癌正式取代肺癌,成为全球第一大癌症。”因此,本次研究对于治疗乳腺癌有着一定积极意义。
与此同时,女性也应注意调整生活方式,中山大学肿瘤医院乳腺癌单病种首席专家、内科乳腺病区主任王树森教授曾对媒体表示:“城镇化以后,职业女性比例越来越高,她们可能会更多选择晚婚晚育,或者选择高龄生育、生孩子不哺乳,这些生活方式的变化,也是导致乳腺癌发病率上升的因素之一。”
编辑:lyn
